❖本調査資料に関するお問い合わせはこちら❖
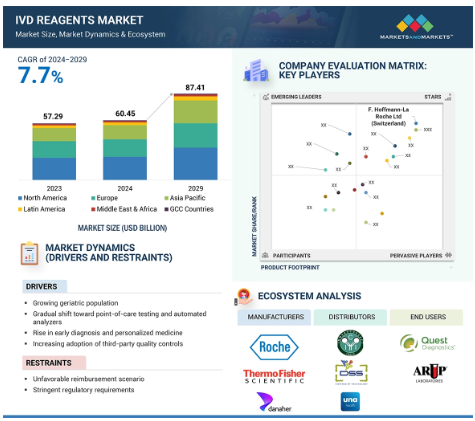
世界のIVD試薬市場は、2023年には5,729万米ドルとなり、年平均成長率は7.7%と堅調に推移し、2024年には6,045万米ドル、2029年には8,741万米ドルに達すると予測されています。体外診断用医薬品試薬市場の成長は、主に診断精度の向上に焦点を当てた分子診断学の技術革新が牽引しています。早期発見のための予防医療に対する意識の高まりも市場の成長に寄与しています。慢性疾患の増加も市場成長を促進する重要な要因です。
IVD試薬市場における魅力的な機会
アジア太平洋地域
市場を牽引する主な要因には、バイオテクノロジーとバイオ医薬品産業の活況が挙げられます。
この市場の成長は、アジア諸国における老人人口の急増と、病院や臨床診断ラボの増加に起因しています。
政府機関による投資の増加は、市場プレーヤーに有利な成長機会を提供すると期待されています。
北米のIVD試薬市場は2029年までに327億ドルに達すると予測され、予測期間中の年平均成長率は6.8%です。
アジア太平洋市場は予測期間中、CAGR 10.0%と最も高い成長が見込まれています。
IVD試薬の世界市場ダイナミクス
DRIVER:ポイントオブケア検査と自動分析装置への段階的シフト
従来の検査室以外で実施される検査の量は、患者により近い場所で治療を提供する需要の高まりにより、今後数年間で増加する見込みです。ポイント・オブ・ケア(POC)検査試薬で利用できる検査の種類は、近年大幅に拡大しています。例えば、イムノアッセイベースのPOC検査分析装置は、患者のコンプライアンスを確保しながら高い感度を提供します。さらに、これらのシステムは、HIV、マラリア、デング熱、結核、C型肝炎など、さまざまな疾患の診断と管理に必要な時間を短縮するのに役立ちます。このような利点の結果、POC検査製品は、情報に基づいた臨床判断をサポートし、医療成果を向上させるために広く使用されるようになっています。
制約:厳しい規制要件
欧米諸国では体外診断用医薬品(感染症診断薬を含む)に対する規制や法的要件が厳しくなっています。米国では IVD 製品は 21 CFR 809 で定義され、医療用試薬と同様のガイドラインに基づいて規制されています。FDAは新しいFDAガイダンス文書を発表しました。米国連邦規制では、機器メーカーは機器のさらなる変更について510(k)申請書を提出しなければなりません。新しい申請では、ソフトウェアの更新や既存の機器へのインストール、またはこれらの試薬に加えられるその他の変更が必要になる場合があります。
EUは、指令98/79/ECおよびそれ以前のいくつかの指令から体外診断用医薬品規則(IVDR)(規則(EU)2017/746)に移行し、新しい規制の枠組みに従ってEUで合法的に販売するためには、製品に(Conformité Européenne)CEマークを付ける必要があります。IVDRには2022年5月26日に終了する移行期間があり、2017年5月26日に施行されました。一部の体外診断用医薬品の承認に必要な期間は不透明であり、規制当局が承認を拒否した場合、研究開発への投資が無駄になる可能性があります。
コンパニオン診断薬の重要性の高まり
コンパニオン診断薬には、医療従事者が治療に対する最適な反応に基づいて患者の治療方針を決定するのを支援することを目的とした検査やアッセイが含まれます。コンパニオン診断薬を治療薬と共同開発することで、医薬品開発プロセスが大きく変わり、治療効果を高めたより安全な医薬品が迅速かつコスト効率よく得られるため、医薬品候補の商業化が可能になります。高価格の専門治療薬やより安全性の高い薬剤に対する需要の増加に伴い、コンパニオン診断薬市場は高い成長の可能性を秘めています。コンパニオン診断薬の重要性の高まりは、診断薬部門、ひいては体外診断用医薬品市場にも成長機会をもたらします。
課題 臨床プロセスにおける運用上の課題
微生物の急速な変異や伝染病の増加により、臨床検査室は迅速なサンプル診断が可能な革新的技術を導入する必要があります。しかし、高度な診断製品を操作できる熟練した検査技師が不足していることが、特に新興市場における全体的な導入の妨げとなっています。さらに、手作業から自動化への移行に対する消極的な姿勢も、市場成長の課題となっています。多くの医療機関は、手作業や従来型のアプローチからITベースのアプローチへの移行が難しいと感じているか、移行を好まない可能性があります。
世界のIVD試薬市場のエコシステム分析
エコシステム分析では、IVD試薬市場に存在する要素を描写し、市場に徹底的に影響を与える特定の市場の相互関連する構成要素を理解します。IVD試薬の利害関係者は、エンドユーザーやアプリケーションなどの重点分野で構成されます。IVD試薬市場は、試薬の種類、アプリケーション、技術、検査タイプ、エンドユーザーの4つのセグメントに分けられます。
種類別では、抗体セグメントが予測期間中に最も高いシェアを記録すると予測されています。
種類別では、抗体、抗原、精製タンパク質・ペプチド、オリゴヌクレオチド、核酸プローブ、その他のIVD試薬に分類されます。抗体は、特に自己免疫疾患や腫瘍学など、臨床現場において幅広い用途があります。抗体を提供する主要企業には、BD(米国)、Revvity(米国)、Grifols, S.A.(スペイン)などがあります。体外診断用医薬品市場における抗体の高いシェアは、テーラーメイド診断における精度の向上と高感度化によるものです。
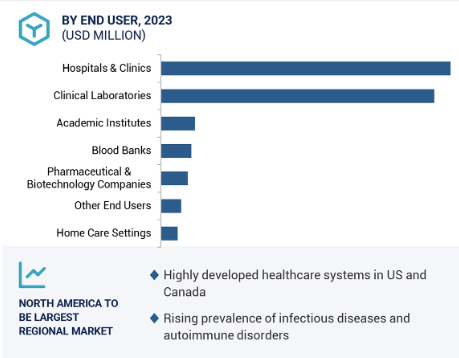
エンドユーザー別では、臨床検査部門が予測期間中に最も高いCAGRを記録すると予測されています。
エンドユーザー別に見ると、IVD試薬市場は病院・診療所、臨床検査室、血液バンク、在宅医療環境、製薬・バイオテクノロジー企業、学術機関、その他のエンドユーザーに区分されます。臨床検査室は、病気とその治療を特定・検出するための診断検査を行っています。高い市場成長は、感染症、血液学、臨床化学、免疫学、病理学の診断検査数が増加しているためです。
2023年、IVD試薬市場で最大のシェアを占めたのは北米で、次いで欧州。
IVD試薬の世界市場は6つの主要地域に区分されます: 北米、欧州、アジア太平洋、中東・アフリカ、中南米、GCC諸国。2023年、北米はIVD試薬市場の最大セグメント。この地域には主要なIVD試薬メーカーが存在することが市場成長を促進する主な要因です。体外診断用医薬品の償還シナリオも複雑ではありません。また、同地域における疾病の有病率の増加も、米国とカナダにおける体外診断用試薬市場の成長を促進すると予想されます。
IVD 試薬市場の最新動向
2024年9月、サーモフィッシャーサイエンティフィック社(米国)が、製薬開発向けの高度なラボサービスおよび機器を提供する検査/ラボセンターを全世界に導入。
2023年12月、ダナハー社(米国)がアブカム社(英国)を買収し、創薬、ライフサイエンス研究、診断の進歩に不可欠なバイオ部門を拡大。
2023年12月、F.ホフマン・ラ・ロシュ社(スイス)がルミラデックス社(米国)のポイントオブケア技術を買収する最終契約を締結。
2022年5月、ホロジック社(米国)がPanther Fusion EBV Quant AssayとPanther Fusion BKV Quant Assayの2つの新しい分子アッセイのCEマーキングを取得。
主要市場プレイヤー
IVD試薬市場の主要プレーヤーは以下の通り
Danaher Corporation (US)
F. Hoffmann-La Roche Ltd (Switzerland)
Abbott (US)
Siemens Healthineers AG (Germany)
Thermo Fisher Scientific Inc. (US)
Illumina, Inc. (US)
BioMerieux (France)
BD (US)
Hologic, Inc. (US)
Bio-Rad Laboratories, Inc. (US)
Sysmex Corporation (Japan)
QIAGEN N.V. (Netherlands)
Agilent Technologies, Inc. (US)
Revvity (US)
DiaSorin S.p.A (Italy)
Grifols, S.A. (Spain)
Werfen, S.A. (Spain)
QuidelOrtho Corporation (US)
Chembio Diagnostics, Inc. (US)
Surmodics, Inc. (US)
Merck KGaA (Germany)
MEDICAL & BIOLOGICAL LABORATORIES CO., LTD. (Tokyo)
Canvax (Spain)
Prestige Diagnostics (US)
Adaltis S.r.l. (Italy)
13.1 主要プレーヤー